昨天发布的《增溶课堂》第一章中,我们介绍过,固体分散体是指药物与载体材料形成的无定形或者晶体状态的分子分散系统,主要分为低共熔混合物、固体溶液、无定形共沉淀物以及玻璃溶液四类。
考虑到载体和API的物理状态和分子排列,我们可以把二元固体分散体分为六个不同的体系:
(1)C-C类:晶体原料药分散在晶体载体中
(2)C-A类:晶体原料药分散在无定形载体中
(3)A-C类:无定形原料药分散在晶体载体中
(4)A-A类:无定形原料药分散在无定形载体中
(5)M-C类:原料药分子分散在晶体载体中(6)M-A类:原料药分子分散在无定形载体中。
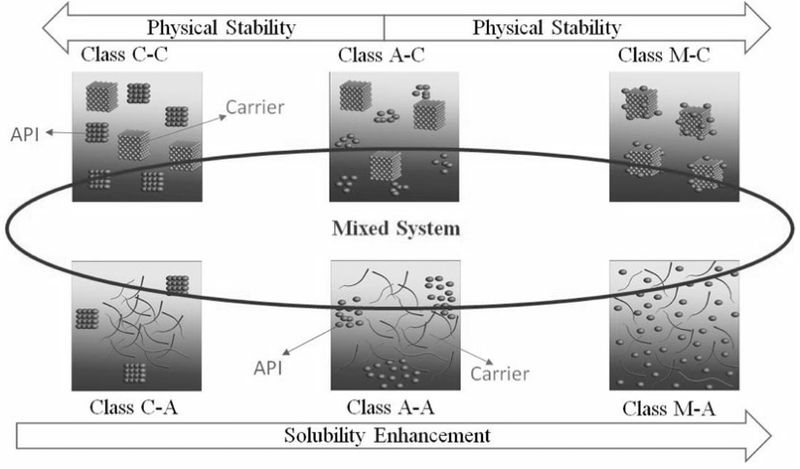
图1 根据载体及API物理结构对二元固体分散体进行分类
固体分散体稳定性的影响因素
我们知道,无定形状态的原料药稳定性要差于结晶状态的原料药。
我们为了提高药物的溶解度,很多时候制备的固体分散体都是无定形的,也就是非晶体固体分散体。所以这个时候我们应该重点关注,在我们产品的效期内,我们的原料药是否发生结晶。
如果发生结晶现象,对我们的产品质量是否发生影响(如药物的崩解、溶出、有关物质以及体内吸收等)?如果对产品质量有一定的影响,则需要保证产品效期内原料药不发生结晶现象。
固体分散体的稳定性如此重要,这就需要我们在设计体系的时候多加注意。
由于C-C类和C-A类原料药已经处于结晶状态,因此物理不稳定性一般不会成为问题。我们应侧重于其他系统的物理稳定性。
在预测固体分散体的物理稳定性时,应考虑API的结晶倾向、玻璃化转变温度、分子迁移率、相互作用等重要因素。
(1)结晶倾向
对于晶态材料而言,玻璃形成能力(即处于非晶态的能力)和玻璃稳定性(即抗重结晶稳定性)反映了其固有的晶化倾向。
低结晶倾向的原料药更容易配制成A-A类、A-C类或M-A类固体分散体。而对于高结晶倾向的原料药,通常会形成A-C类、A-A类或M-C类固体分散体,因为高结晶倾向的原料药很难转变为非晶态。
原料药转化为无定形状态的难易程度主要取决于其分子结构的固有玻璃形成能力。但是即使药物具有较高的结晶倾向,聚合物载体的加入也有助于其形成稳定的无定形分散体。
在针对特定原料药设计高效固体分散体时,我们需要考虑载体选择、载药量和生产条件三个因素。
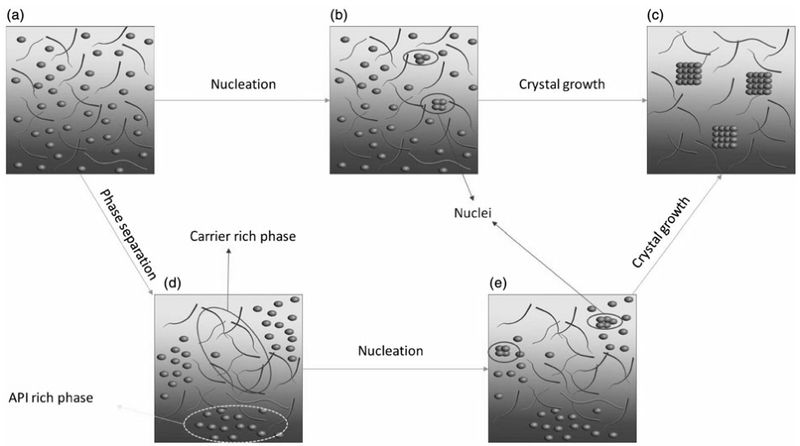
图2 结晶机理
(2)玻璃化转变温度
晶体向玻璃的转变也称为非晶化。
载体通常通过与原料药分子形成分子相互作用而起到有效的抑制结晶的作用,载体的使用也可能影响固体分散体中原料药的玻璃化温度。
玻璃化温度的增加可能会降低固体分散体系的分子迁移率,可能增加药物的物理稳定性。
(3)分子迁移率
结晶可分为两个独立但是相互依赖的的过程,即成核和晶体的生长。
这两个过程需要分子运动导致分子重排,从而形成稳定的晶核,或附着在生长的晶面上;因此,分子迁移率是非晶态体系物理稳定性的关键参数。
分子迁移率是一个与温度和湿度密切相关的参数,它会受到制造或储存条件以及所在体系中的物理化学性质的显著影响,如环境温湿度、固体分散体吸湿性等因素。
分子迁移率与物理稳定性直接相关。
(4)原料、载体相容性
原料与载体的相容性是选择载体的基础,一般原料与载体的相容性越高,则更加容易制备成固体分散体。
目前研究原料与载体相容性的方法有溶解平衡常数的测定以及热分析法。
使用溶解平衡常数的测定法时,一般最后也需要使用热分析法进行最后的确认。
当使用差示扫描量热法检测原料与载体的相容性时,如果原料与载体的相容性良好,则固体分散体混合物会产生一个介于原料与载体之间的玻璃化转变温度(Tg)值,并且只有一个;当原料与载体的相容性不好时,则会产生两个或两个以上的吸热熔融峰,且吸热熔融峰相互间是分离开的。
固体分散提高药物溶解度机制
目前大家对固体分散体进行了大量的研究,但对固体分散体改善难溶性药物溶解度机理的研究还很少,下面我们来了解下固体分散体提高药物溶解度的机制吧。
(1)通过减小药物粒径
提高药物在水中的表观溶解度的最简单方法之一是减小其颗粒大小。
粒径减小导致颗粒比表面积增大,从而增加了与溶解介质的接触,提高了其表观水溶性。
固体分散体颗粒可以减少团聚,从而改善药物溶解性。例如,阿苯达唑与泊洛沙姆407或PEG 6000的固体分散体,由于粒径减小和润湿性增加,药物的表观溶解度增加。
(2)通过改变药物晶型
一些固体分散体通过改变药物晶型来改善药物的表观水溶性和溶出度,一般将药物的由稳态的晶型转为亚稳态的晶型或无定形。这样就表现出比结晶药物更高的溶解度。
固体分散体提高难溶结晶药物表观溶解度最常见、最重要的机制是将其转化为无定形状态。
热力学上,与其相应的晶态相比,非晶态固体具有更高的瞬时溶解度、溶解速率、蒸汽压和分子迁移率。
(3)通过载体、药物或介质pH
固体分散体的溶出度可以由载体控制、药物控制或生理介质控制。
例如盐酸去甲替林在聚乙二醇3400为载体的固体分散体中的溶出速率,与PEG浓度和分子量有关,表明溶出速率是由载体控制的。
在灰黄霉素与PEG的固体分散体系中,灰黄霉素的溶出速率取决于灰黄霉素的颗粒大小,从而表明溶出速率是药物控制的。
消炎痛与载体乙基纤维素的固体分散体系中,在较低pH的介质中消炎痛的释放被延缓,从而表明溶解速率受生理介质pH的控制。
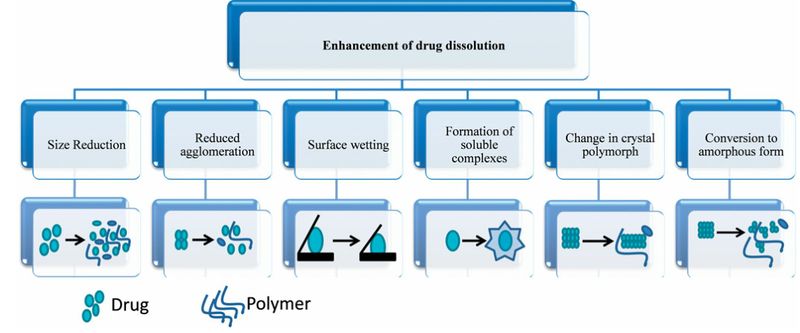
图3 固体分散提高药物溶解度机制
制备方法
制备固体分散体的方法很多,包括共磨法、熔融法、溶剂蒸发法和共沉淀法。制备方法的选择是至关重要的,每一类固体分散体的制备方法选择策略如图4所示。
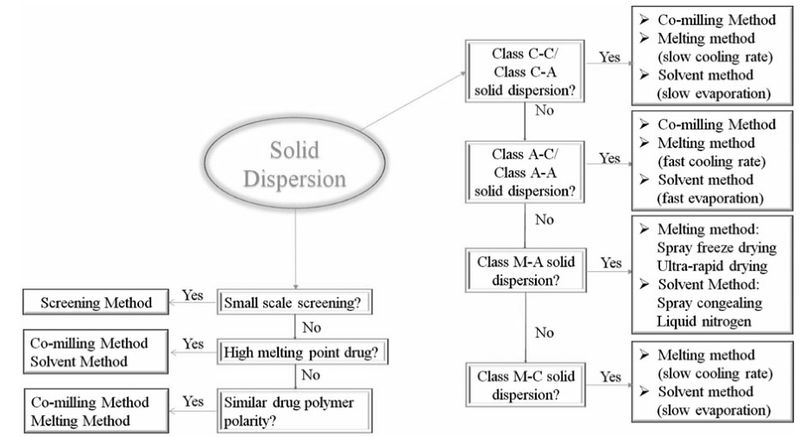
图4 固体分散法制备方法的选择策略
(1)共磨法
共磨法是一种低成本、易于操作的固体分散体制备方法。在这种方法通常原料药和载体在带有不锈钢罐和球的磨机中混合,经过数小时的磨制,得到最终产品。
共磨方法能显著减小药物颗粒的尺寸,并能使药物由晶态转变为非晶态。共磨法制备的固体分散体药物-载体相互作用最少,但是物理稳定性最差。
(2)熔融法
熔融法是制备固体分散体最早也是最常用的方法之一。将原料药与不同载体熔融,经过冷却、粉碎、筛分等一系列工序,制得固体分散体粉末。
但是传统的熔融法有两个严重的局限性:
①熔融过程需要较高的温度,在生产过程中可能会发生原料药或载体的降解或分解。例如,用熔融法获得槲皮素固体分散体需要300℃左右的温度,而常用的聚合物在这样的温度下可能会降解。因此,熔点较高的药物可能不适合采用熔融法。
②熔融法只有在药物和载体在熔融状态下可混溶时才能使用,如果药物和载体不能相容,则可能在熔融的混合物中形成两个液相或悬浮液,从而导致非均相固体分散体的形成。
因此,结晶或半结晶载体,如聚乙二醇(PEG)、泊洛沙姆由于其与结晶API相似的理化性质,在熔融方法中被广泛使用。
(3)溶剂法
溶剂法是一种常用的小规模制备固体分散体的方法,涉及API和载体在挥发性溶剂中的增溶作用。
这种方法,可以防止原料药或聚合物的热降解,因为该过程可以在不过度加热的情况下进行。
溶剂挥发法的基本过程包括两个步骤:
①将API和载体的物理混合物溶解在普通溶剂或溶剂混合物中;
②去除溶剂以获得固体混合物。
溶剂法目前有个主要的挑战,限制了它在固体分散体的大规模生产中的应用。即API和载体溶于到一溶剂中,如果原料药和载体在极性上有很大的不同,就会变得非常困难。
所以为了避免浪费物料,在使用溶剂法之前,我们可以先对药物和载体在选定溶剂中进行少量溶解。
可以溶解最大量的API-载体物理混合物的挥发性溶剂是首选溶剂。通常使用低沸点的溶剂,如甲醇、乙醇、二氯甲烷、丙酮和氯仿或它们的混合物。
预热溶剂或持续缓慢加热可以提高物理混合物的溶解度,有助于形成更均匀的体系。随后采用真空干燥、喷雾干燥、冷冻干燥等方法进行固体分散体的制备。
在真空干燥方法中,溶液在中温(通常为50~80℃,取决于溶剂)下真空干燥,形成的固体分散体通常储存在真空干燥器中,以完全除去残留的溶剂。有时使用旋转蒸发器或烘箱来加速干燥。
在喷雾干燥方法中,API载体溶液被雾化成细小的液滴,并喷入加热气流中以除去溶剂。由于液滴的比表面积大,溶剂可以迅速脱除,形成细小的固体分散颗粒。
除了快速蒸发外,喷雾干燥技术的另一个优点是显著减小了颗粒尺寸。喷雾干燥制得的最终颗粒的大小与液滴大小直接相关,我们可以通过改变喷液速度、改变溶液浓度等方式来控制所得颗粒的大小。
冷冻干燥,又称升华干燥,是制备固体分散体的一种重要方法,因为它可以在较低的温度下操作,可以有效地降低相分离和降解的风险。
载体的选择
载体的选择主要考虑三方面因素,即安全性、动力学和热力学方面。
传统观点认为,任何用于药物配方的赋形剂在化学和药理上都应该是惰性的,这也同样适用于固体分散体制备中对载体的选择。
首先从安全性方面考虑,所选载体在人体内必须是安全的。从动力学角度看,该载体应该能够抑制药物在胃肠道环境中转晶或沉淀。从稳定性的角度来看,热力学因素对于无定形固体分散体的物理稳定性是比较重要的。
聚合物必须具有较高的玻璃化转变温度,以便制备的固体分散体在室温下具有良好的稳定性。
(1)聚乙烯比咯烷酮
聚乙烯吡咯烷酮是配制固体分散体最常用的载体之一。它是一种具有无定形物理状态的亲水聚合物,它可溶于水、乙醇、异丙醇和氯仿。
由于在挥发性溶剂如乙醇中的溶解性,聚乙烯吡咯烷酮适用于通过溶剂法制备固体分散体。
聚乙烯吡咯烷酮的玻璃化转变温度与其分子量成正比。
大多数高分子量聚乙烯吡咯烷酮通常具有高玻璃化转变温度(Tg),高玻璃化转变温度使得它不适合熔融法制备固体分散体,特别是对于低熔点和热不稳定的药物。
(2)共聚维酮
共聚维酮是乙烯基吡咯烷酮和醋酸乙烯酯的共聚物,是一种无定形的水溶性聚合物。
由于醋酸乙烯酯取代基的亲水性相对较差,所以聚维酮亲水性也较差,所以能够与具有不同极性的多种原料药表现出相似溶解性。
而且聚维酮的玻璃化转变温度在100℃左右,而降解温度大约需要230℃,由于聚维酮玻璃化转变温度与降解温度相差较大,这为熔融法提供了机会.
我们可以通过熔融法,使用共聚维酮作为载体来制备固体分散体。
(3)聚乙二醇
聚乙二醇是分子量在200~300000g/mol的环氧乙烷聚合物。
聚乙二醇的物理状态取决于其分子量。分子量在600以下的聚乙二醇在室温下为粘性液体,而分子量在8000和20000以下的聚合物分别为蜡质和干固体。
聚乙二醇是一种半结晶聚合物,其结构中既有结晶结构域,又有无定形结构域。
聚乙二醇具有55~68°C的低熔点,在水中以及许多挥发性有机溶剂,如甲醇、乙醇和氯仿中具有良好的溶解性。
由于聚乙二醇在许多挥发性有机溶剂具有良好的溶解性,所以适用于溶剂法制备固体分散体。
由于聚乙二醇熔点较低,所以适用于与低熔点药物通过熔融法制备固体分散体。
(4)纤维素衍生物
纤维素衍生物是制备无定形固体分散体常用的载体。
纤维素衍生物由于分子量高,所以不能从胃肠道吸收,并且纤维素衍生物具有与药物分子相互作用强以及玻璃化转变温度高的特性。
常用的有甲基纤维素(MC)、乙基纤维素(EC)、羟丙基纤维素(HPC)等。
(5)羟丙基甲基纤维素
HPMC属于纤维素类聚合物的一个大类。
HPMC是一种非离子型亲水性聚合物,可溶于水和大多数有机溶剂,包括甲醇、乙醇、丙醇和二氯甲烷。
由于HPMC在有机溶剂中易溶,适合喷雾干燥来制备固体分散体。
由于HPMC的水溶解性,适合冷冻干燥技术来制备固体分散体。
虽然纯纤维素是半结晶的(结晶度为50-60%),但HPMC是以无定形状态存在的,其玻璃化转变温度达到180°C,因此HPMC不适合熔融法制备固体分散体。
在我们药物研发过程中,不可避免的会遇到难溶性的药物溶解度差的问题,希望当遇到这个问题而没有头绪时,小编的一篇文章可以为大家提供一点点思路。
声明:铭研医药对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)







