近年来,蛋白类药物由于在肿瘤、关节炎、糖尿病、心血管疾病等适应证上,显示出了作用靶点特异、疗效突出、安全性好等优点,极大满足了病患需求,已经成为药物研发的最重要领域之一。然而,蛋白类创新药物由于巨大的研发成本,且价格高昂,严重影响了药物的可及性。各国监管机构纷纷出台政策法规指导和鼓励生物类似药的研发。
2015年国家药品监督管理局药品审评中心发布了《生物类似药研发与评价技术指导原则》后,国内迎来了生物类似药的研发热潮,目前已陆续有相关产品获批上市。
蛋白类药物由于多数采用哺乳动物细胞表达体系,细胞内存在着复杂的翻译后修饰和酶类反应,造成了表达产物在糖基化分子结构的多样性,生产工艺和细胞株的微小变化都可能导致目的蛋白糖修饰基团结构上的明显差异,因此,生物类似药基本上无法做到与原研产品在糖基化分子结构上完全一致。
相对于小分子药物,现有科学研究对单抗等大分子蛋白药物的分子结构与功能的认知仍然存在局限。目前对大分子药物之间的相似性评价方面往往需要综合药学、动物和人体等试验数据,结构和质量的相似性研究的深度和程度决定了开展人体临床评估的必要性和程度。
各国监管机构鼓励研发企业采用最新的分析技术手段对原研药和生物类似药的结构进行深入研究,证明与原研药的“相似性”。
蛋白糖基化是一种重要的翻译后修饰,造成了蛋白药物糖基化修饰分子结构上的多样性和异质性。蛋白糖基化对蛋白的免疫原性和有效性有重要影响,被普遍认为是治疗性蛋白药物最重要的关键质量属性(CQA)之一。
细胞基质和生产工艺的变化都可能影响终产品蛋白的糖基化修饰的组成和结构。因此,研发单位需要对不同研发阶段的蛋白药物进行全面深入的表征,保证生产工艺的一致性、产品的安全性、生物类似药和原研药的可比性。本文将以IgG类单克隆抗体为例,介绍蛋白类药物审评工作中糖基化结构表征的重要性以及生物类似药糖基化结构表征的技术考虑。
蛋白药物的糖基化结构和功能
蛋白糖基化修饰一般为寡糖结构,多数单克隆抗体糖基化修饰为N-连接寡糖。IgG型单克隆抗体在Fc段的Asn-297均有一个保守的N糖基化位点,与Fc段的免疫效应功能密切相关。
除Fc糖基化外,约20%的IgG在Fab区域存在另一个N-连接的糖基化位点,这2个糖基化位点都位于重链上。除N-连接的糖基化外,极少数单克隆抗体药物中也存在O-连接的糖基化。
O-连接的糖基化是糖链和蛋白质中的氨基酸(丝氨酸、苏氨酸、羟赖氨酸)残基中的氧原子的连接,其主要发生在真核生物的高尔基体上。由于O-连接的糖基化位点无保守序列且糖链无固定的核心结构,其结构更加复杂多变。
本文主要以单克隆抗体药物最常见的N-连接糖基化为例进行介绍。N-连接寡糖一般具有“双触角/双分枝”的五糖核心结构,该结构由甘露糖(Man)和N-乙酰葡糖胺(GlcNAc)2种己糖分子组成,不同糖型除核心结构外还另外含有不同数目的糖分子,如岩藻糖(Fuc)、甘露糖、N-乙酰葡糖胺、半乳糖(Gal)、二等分N-乙酰葡糖胺和唾液酸(Sia)。糖链的长度、分叉形式和单糖序列的变化导致了糖基化修饰的复杂性。
根据不同的连接方式使得N-糖基化的五糖核心结构分为高甘露糖型、杂合型和复杂型3种类型(图1)。
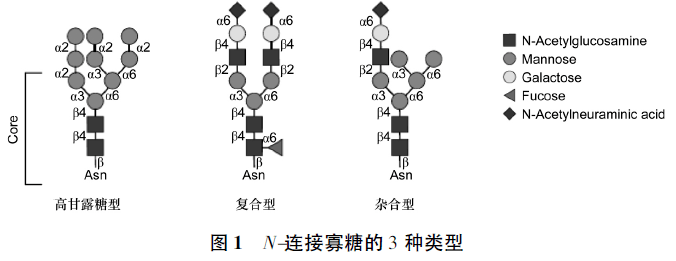
与其他糖蛋白相比,多于2个触角/分枝的结构在单抗分子中通常不多见,且唾液酸含量也较低。单抗的Fc段与其受体FcRs结合发挥抗体依赖细胞介导的细胞毒作用(antibody dependent cell-mediated cytotoxicity,ADCC)、激活C1q发挥补体依赖的细胞毒作用(complement dependent cytotoxicity,CDC),与新生Fc受体(neonatal Fc receptor,FcRn)结合介导清除作用,糖基化修饰通过影响Fc段功能区的结合来调节ADCC,CDC以及药物半衰期,无糖基化修饰的IgG则由于缺失了与C1q和FcRs的结合能力而不能引发ADCC和CDC作用。
Fab段和Fc段特定的糖基化修饰还会诱发免疫原性。已有研究证明,核心岩藻糖基化、末端半乳糖、唾液酸的含量可以显著影响抗体Fc段介导的效应功能,进而影响抗体药物的疗效、安全性和药动学性质。
糖基化的生物学表征
如前所述,抗体结构中的糖基化修饰基团对抗体的功能有重要影响。抗体结构中糖基化基团修饰类型和程度以及不同的翻译后修饰水平造成了抗体糖基分子结构的异质性,其可以通过改变抗体构象等方式,影响抗体的生物活性。因此,对抗体相关的生物活性测定是糖基化修饰结果分析判别的方法之一,也是生物类似药相似性评价的重要组成部分。
活性测定按方法原理不同可以分为2类:①测定受体和靶蛋白的结合。②测定受体/靶蛋白结合后的生物效应。
常见的测定抗体功能/活性的试验方法有无细胞参与的结合试验、有细胞介入的结合试验、细胞活性试验,这3种方法就其技术上来讲,虽然其稳定性、灵敏度、重现性逐步降低,但相应的对抗体体内活性的预测和参考价值是逐渐递增的,因此一般鼓励研发单位建立细胞模型的生物活性测定方法。
需要注意的是,由于抗体结构上或试验细胞体系上的差异,同一种活性测定方法对同靶点的不同抗体药物可能并不完全适用,需要在方法移植/转移前进行系统的方法学验证。参照药和生物类似药的受体/靶蛋白结合动力学参数可能存在差异,生物类似药的研发机构在方法设计上应全面考虑,不建议使用某一剂量下的活性数据评价二者的相似/不相似,建议考察量效反应的整体性特征。
另外,采用活性方法评价生物类似药也有一定的局限性。生物活性测定方法本身灵敏度不高,不一定能够发现生物类似药和参照药的区别;活性方法建立在抗体药物的作用机制的基础之上,并不是每一种机制都适合用来开发生物活性方法。因此,仅靠活性方法并不能充分确定生物类似药的相似性。
研究单位通常在生物类似药的开发过程中,采取系统灵敏的理化分析手段检测产品之间糖基化修饰基团和结构上的差异,结合相关的活性方法一起进行生物类似药与参照药的相似性评估,证明二者的糖基化单糖组成与含量、糖链结构、相关活性的综合相似性。
糖基化修饰结构的理化方法表征
蛋白糖基化中的寡糖为非模板合成,结构极其复杂,糖基化结构表征难度远超核酸和氨基酸序列表征。FDA,EMA生物类似药相关的指导原则都鼓励研发单位采用最新的分析技术手段,对生物类似药和原研药的糖基化修饰位点、程度以及寡糖的组成进行深入比较研究。
为制订相似性评价的接受标准,研发单位应采用足够批次的参照药与生物类似药进行比较研究。FDA建议用于相似性评价的样品批次一般不低于10批,并尽可能覆盖产品间的差异,如不同货架期、不同规模的产品,参照药的批次应考虑纳入欧、美不同产地来源等。
蛋白的糖基化修饰结构分析可根据测试样品分子量大小一般分3个水平进行,即完整蛋白(top)和亚单位蛋白(middle-up)、糖肽(bottom-up)、游离寡糖。
3.1完整蛋白和亚单位水平
色谱、电泳和质谱技术目前已经广泛用于完整蛋白水平的糖基化修饰分析,可以提供完整蛋白的分子量大小等信息。亚单位蛋白水平的分析通常采用化学还原单抗分子中的二硫键或者蛋白酶酶切等方法,通过制备分子量较小的亚单位,以便对单抗分子中的变异体进行分离,提高质谱的灵敏度。
完整蛋白和亚单位的水平分析中常见技术包括RPLC-MS,CE/CIEF,MS(MALDI或ESI)和凝集素糖蛋白识别芯片等,一般均具有快速、方便、重现性好等优点,广泛用于不同开发阶段的生物类似药和参比品主要糖型结构的比较分析,还可以用于单抗重链之间寡糖的对称性分析。
完整蛋白和亚单位水平的分析并不能提供糖基化修饰结构的精细信息。完整蛋白和亚单位的质谱法测定容易受到蛋白同位素峰的影响,对单一同位素峰的灵敏度较低,只能提供抗体的平均分子量信息,即使高分辨率质谱也不能获得更多信息。
因此,从完整蛋白和亚单位水平很难进行精细的翻译后修饰的检测,也难以获得准确的糖型(尤其是低丰度糖型)及糖基化位点的相关信息。
3.2糖肽水平
糖肽水平的分析通常用胰酶等蛋白酶对完整蛋白进行的酶解,产生分子量大约为0.5~5kDa的小肽,采用色谱或电泳分离后再进行MALDI-MS或ESI-MS分析。因为其提供的肽段丰富,可以提供氨基酸序列、糖基化、微小的化学和酶修饰等信息。
糖肽水平的质谱分析不仅可以提供糖基化位点信息,还可以借助串联质谱(MS/MS)技术对糖肽序列、寡糖组成进行解析。
基于上述优势,以质谱技术为基础的糖肽分析在抗体批次间一致性评估、生物类似药和参照药相似性评估方面已经广泛应用。
需要说明的是,糖肽水平的分析应该归属于糖基化修饰的定性分析,鉴于单抗产品复杂的糖基化修饰,还需要进一步借助寡糖的定量分析手段进行表征。
3.3游离寡糖分析
游离寡糖的分析方法已经进行了广泛的研究,企业界和学术机构都有大量的文献报道。通常采用酶法或化学试剂法使寡糖从完整蛋白中游离出来,以便进一步对寡糖组成和含量进行深入分析。
对N-连接寡糖常用酰胺酶如肽N-糖苷酶F(PNGase F),其可定向切割N-乙酰葡糖胺(GlcNAc)与蛋白结构中的天冬酰胺的酰胺键,使寡糖脱离以便进一步分析。如果蛋白结构中含有N-连接和O-连接糖基化,通常采用肼解反应或还原性β-消除反应。
对游离寡糖的分析通常有3种方法:①配有脉冲电流检测器的高效阴离子交换色谱法(HPAECPAD);②直接质谱分析(MS);③配有荧光检测器或质谱检测器的高效毛细管电泳法(HPCE)。
寡糖结构中无生色团,常采用荧光试剂标记后进行光谱检测,如毛细管电泳分析中N-寡糖的分析常使用激光诱导荧光检测技术,使用8-氨基-萘-1,3,6-三磺酸(APTS)作为标记物。亲水相互作用色谱(HILIC)使用2-氨基苯甲酰胺(2-AB)或2-氨基苯甲酸(2-AA)对寡糖进行标记。
质谱法虽然可以直接对寡糖进行检测,但采用化学标记后进行质谱检测能极大提高离子化效率,并可提供更多的片段结构信息。因此,借助色谱-光谱/质谱技术,可以对寡糖进行定性和定量分析。
生物类似药开发和评价中关于糖基化修饰的一般考虑
糖基化修饰对单抗药物的疗效、稳定性、免疫原性、药动学性质等具有重要影响,因此一般情况下糖基化修饰被认为是单抗药物的一个关键质量属性(CQA)。研发人员可以根据抗体的作用机制,针对性的优化抗体分子中糖基化结构和水平,如采用敲除岩藻糖方式以提高其ADCC活性等,以达到开发更优的有效性、安全性或改善药动学等目的。
此时除了对单抗产品的糖型进行全面表征外,研发单位应根据抗体的分子结构特点设计合适的理化和活性评价方法,对其特异的糖基化修饰结构进行质量控制;动物和临床试验中,应重点关注分子优化设计的有效性、安全性以及对药动学/药效学(PK/PD)的影响。
单抗药物的糖基化修饰具有复杂的结构和组成,常见的单抗产品N-糖型主要为G0F,G1F,G2F,M5等的混合组成,部分糖型如OligoMan占比较高则可能会影响免疫原性或半衰期。生物类似药的研发单位应该对参比品的糖基化修饰信息进行充分调研,通过合理的理化分析、体内外试验综合评价拟开发药物与参比品的相似性程度。
质量研究过程中注意对单抗药物的糖基化结构表征应全面,综合运用活性和理化表征手段,理化表征由点及面,通过完整蛋白和亚单位蛋白、糖肽、游离寡糖水平的分析,全面反映糖基化修饰的位点、寡糖种类、结构以及丰度。
考虑到大分子药物及糖基化基团修饰的复杂性,监管机构鼓励研发单位采用最新的技术手段对抗体糖基化结构进行深入研究。鉴于理化表征的灵敏度一般高于体外活性和体内试验,对糖型理化分析后得出的差异应合理评估。
FDA生物类似药相关指导原则中关于质量研究的相似性评价一般得出不够相似、未确定性相似、实验性相似、指纹相似4个结论,对未确定性相似的说明中以糖基化结构特征为例,建议理化分析后存在的不确定性,可以通过PK/PD研究进一步评价,以此来确定理化分析后糖型相关参数的相似性可接受范围。
单抗产品的糖基化修饰主要受宿主细胞酶催化机制、高尔基体内转运时间、环境因素和所能获得糖核苷酸影响。多因素相互作用使得各生产批次糖型很难完全相同,即使同一制造商使用相同的设备和工艺过程。
单抗药物研发单位在产品的临床前及临床研究阶段,需要进行持续的糖基化修饰特征的监测和控制,对产品批次间差异的可接受范围进行限定,不断积累数据和控制经验,以确保上市产品质量的一致性。
一些先进的生物制药企业已经率先将质量源于设计(QbD)理念用于单抗药物的开发,通过对糖基化修饰等关键质量属性的深入分析,设计合理的工艺参数空间,进一步达到了产品质量靠生产过程的严格控制而非依靠检验的目的。
建议生物类似药的研发企业通过对多批次参照药的糖型分析、体外活性测定、非临床和临床试验结合文献调研,在生物类似药开发过程中不断积累数据,运用多变量分析等统计学手段,设计与参照药相似性相关的多参数操作空间,进而建立相似性评价的工艺与质量可接受标准。
结语
蛋白的糖基化是一种重要的翻译后修饰,糖基化蛋白中的寡糖为非模板合成,并呈复杂的树枝状结构,据报道仅由6种单糖组成的寡糖链,其理论结构即达到惊人的1012种。
宿主细胞、生产工艺等各种影响因素更增加了糖基化修饰结构的复杂性。审评中经常发现不同申报厂家的生物类似药单抗产品其糖基化修饰存在明显差异。即使欧美已获批上市的生物类似药与参照药、生物类似药批次之间的糖基化修饰结构差异亦有报道。
Giorgetti等采用CZE-ESI-MS技术评价了Remicade与其类似药Remsima/Inflectra的糖基化修饰,发现了二者糖型中8种N-寡糖的相对丰度存在明显差异,Pisupati等采用LC-MS/MS技术进行测定也得出了类似的结论。
生物类似药糖基化修饰基团结构上的差异对产品的有效性、安全性的影响程度需要结合药物作用机制以及药效、毒理和临床数据综合评估。从质量研究角度阐明这些差异,在动物及人体试验中针对性的观察糖基化修饰基团结构上的差异可能的影响,对于评价其相似性并支持产品最终上市有重要意义。
文章来源:《中国新药杂志》
原标题:《生物类似药糖基化相似性评价中的审评思考》
作者:张忠兵,韦薇,罗建辉(国家药品监督管理局药品审评中心,北京)
声明:铭研医药对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)







